
Projeto Incluir – Doentes e Associações de Doentes
O Infarmed criou o Projeto Incluir, que irá constituir um instrumento de ligação com o cidadão e, em particular, com o cidadão portador de doença ou seu representante.
Através deste projeto, pretende-se alargar a interação de doentes/associações de doentes no processo de avaliação de tecnologias da saúde e outras áreas como as roturas de medicamentos, notificação de reações adversas ou medicamentos contrafeitos.
A integração neste projeto depende de prévia acreditação, através do preenchimento de um formulário que vai estar disponível em breve no website do Infarmed, assim como, o documento de enquadramento do Projeto. Os formulários para efeitos de acreditação serão disponibilizados nesta página após conclusão da discussão pública.
Os critérios de legitimação utilizados no Projeto seguem critérios internacionais utilizados pela Agência Europeia de Medicamentos (EMA), pelo National Institute for Health and Care Excellence (NICE) e pela norte-americana Food and Drug Administration (FDA).
Este documento encontra-se em consulta pública até ao dia 10/11/2017. Os comentários ao documento devem ser submetidos através do e-mail associacoes.doentes@infarmed.pt.

Infarmed apoia reinstalação das farmácias
destruídas pelos incêndios
Os trágicos incêndios ocorridos nos últimos dias, que levaram o Governo a declarar o estado de calamidade pública nas regiões afetadas, destruíram totalmente duas farmácias: a Farmácia da Lajeosa e a Farmácia Central, situadas, respetivamente, em Lajeosa do Dão (concelho de Tondela) e em Melo (concelho de Gouveia).
O Conselho Diretivo do Infarmed já expressou a sua consternação e solidariedade com os proprietários e diretores técnicos das farmácias afetadas e está a acompanhar todo o processo de reinstalação, contribuindo para que as farmácias se mantenham em funcionamento e as populações locais tenham acesso aos serviços e produtos de que necessitam.
O Infarmed tem estado em contacto com os proprietários e diretores técnicos destas farmácias para assegurar o seu funcionamento em instalações provisórias, nas respetivas juntas de freguesia, e disponibilizou todo o apoio técnico necessário à reposição da normalidade, tendo em vista a futura reabertura das farmácias em instalações definitivas.
Infarmed organiza ‘Manhã Informativa’ sobre as
novas funcionalidades da plataforma EudraVigilance
As novas funcionalidades do Eudravigilance estarão disponíveis a partir de 22 de novembro. Para preparar este lançamento a Agência Europeia de Medicamentos (EMA) necessita de assegurar um período de inatividade do Eudravigilance que decorrerá de 8 a 21 de novembro de 2017. Com esta adaptação dos sistemas informáticos dá-se início ao envio centralizado de casos de reações adversas a medicamentos (ICSRs). A recepção, pelo Infarmed, de ICSR submetidos pelos TAIM termina no dia 6 de novembro de 2017
O documento EudraVigilance Go-Live Plan, publicado pela EMA, e a Circular Informativa N.º 131/CD/100.20.200, emitida pelo Infarmed, descrevem os sistemas informáticos do EudraVigilance (EV) que serão afetados, os respetivos períodos de inatividade e as orientações a seguir pelos titulares de autorização de introdução no mercado (TAIM) durante esse período.
Para assegurar que os TAIM estarão preparados para esta mudança, o Infarmed organiza uma sessão de esclarecimentos onde serão discutidas as principais alterações e o seu impacto. Esta sessão realizar-se-á no dia 27 de outubro de 2017, pelas 10h30, no Auditório do Edifício Tomé Pires do Infarmed, no Parque de Saúde de Lisboa. Todos os interessados em participar nesta Manhã Informativa devem inscrever-se através do website do Infarmed (agenda de eventos), até ao próximo dia 24 de outubro de 2017. Para garantir maior eficiência da sessão as questões sobre o tema devem ser endereçadas para farmacovigilancia@infarmed.pt, até ao dia 23 de outubro de 2017 a fim de permitir a sua abordagem durante a sessão informativa.

Genéricos – Qualidade, Segurança, Eficácia e Poupança
As poupanças com a utilização de genéricos são evidentes para todo o sistema de Saúde (Estado e utente).
Uma das situações que criava algumas dificuldades na entrada de mais medicamentos genéricos no nosso país foi desbloqueada com a implementação da Lei n. º 62/2011 que permitiu a avaliação de medicamentos que se encontram suspensos por providência cautelar. O ano de 2012 foi o ano com maior número autorização de comparticipação de medicamentos genéricos.
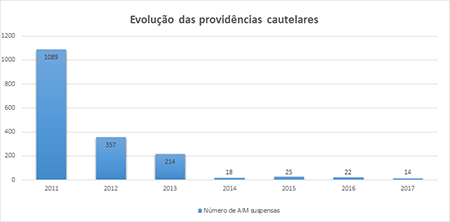
Quando o medicamento genérico é introduzido no mercado comparticipado do SNS inicia-se um efeito concorrencial e uma redução de preços global. No entanto, no período 2011-2014, com a intervenção externa, foram implementadas outras medidas para redução de despesa como é possível verificar neste Relatório de 2012.
Neste momento, a quota de medicamentos genéricos já atingiu os 48%, sendo que o objetivo e a tendência é que a percentagem de utilização destes medicamentos continue a aumentar. Para cumprir com esse desiderato o Ministério da Saúde e o Infarmed têm tomado um conjunto de medidas para assegurar o crescimento desta quota, desde campanhas de informação até um conjunto de incentivos às farmácias pela venda dos quatro medicamentos mais baratos de cada substância ativa (quando há grupos homogéneos).
Em breve haverá ainda um aperfeiçoamento nas fórmulas de cálculo desta quota, aproximando Portugal dos sistemas utilizados noutros países e que terão impacto no crescimento desta quota.


