
Rui Santos Ivo eleito Presidente do Conselho de Administração da EMA
Rui Santos Ivo, Presidente da Autoridade Nacional do Medicamento e Produtos de Saúde, I.P. (INFARMED) foi eleito, Presidente do Conselho de Administração (Management Board) da Agência Europeia de Medicamentos (EMA) em reunião do organismo.
Após ter sido nomeado vice-presidente do órgão que agora vai presidir, em outubro de 2024, esta eleição reforça ainda mais o reconhecimento da vasta experiência e liderança de Rui Santos Ivo na área da regulação do medicamento. Reflete a confiança dos Estados-Membros da União Europeia na sua capacidade de contribuir para a Rede Europeia de Regulação do Medicamento, que integra as autoridades nacionais dos Estados-membros e a EMA.
A nível europeu, já representava Portugal no Conselho de Administração da EMA (desde 2016) e assume o papel de Chair do Grupo de Chefes das Agências de Avaliação de Tecnologias de Saúde (HAG) (desde setembro de 2021).
Rui Santos Ivo abraça um desafio para os próximos três anos, sucedendo no cargo a Lorraine Nolan, Diretora Executiva da Autoridade Reguladora dos Produtos de Saúde da Irlanda (HPRA), que concluirá o seu mandato como presidente do Conselho em 21 de março de 2025.
Esta nomeação é um reforço da posição de Portugal e do INFARMED no palco europeu da regulação de medicamentos e representa um reconhecimento do contributo nacional para a saúde pública na União Europeia.
Saiba mais aqui.

Novo Regulamento Interno do INFARMED, I.P., em vigor desde 15 de março
Com a publicação da alteração aos Estatutos do INFARMED, I.P., através da Portaria nº 4/2025/1, de 3 de janeiro, entrou no último sábado, dia 15 de março, em vigor, o novo Regulamento Interno do Infarmed (1) que introduz uma nova organização da estrutura do instituto, acolhendo novas unidades orgânicas flexíveis.
O novo regulamento procede, a par da reorganização e reforço nas várias áreas de intervenção do Infarmed, à criação de novas unidades em áreas transversais e outras em desenvolvimento e emergentes, consubstanciando desta forma as alterações essenciais ao modelo de organização e funcionamento. Assim, procura responder melhor às necessidades identificadas, aos desafios e à complexidade crescente das áreas de atuação do Infarmed, tanto a nível nacional, como europeu e internacional.
“Esta reorganização que agora iremos concretizar constitui uma reforma estrutural e essencial para o INFARMED, I.P., com o duplo objetivo de responder aos novos desafios e responsabilidades para com os cidadãos e, ao mesmo tempo, aproximar as lideranças internas de todos os colaboradores para melhores condições de gestão”, afirma Rui Santos Ivo, Presidente do Conselho Diretivo do Infarmed.
A criação e operacionalização das novas unidades estabelecidas pela presente deliberação será feita de forma gradual e progressiva durante os próximos meses.
Com estas mudanças, é reforçada a capacidade interna de adaptação e inovação decorrentes da evolução científica e regulamentar, a natureza matricial e transversal da atividade e uma maior capacidade de gestão e proximidade das lideranças nas diferentes áreas.
Consulte aqui o organograma do INFARMED - Autoridade Nacional do Medicamento e Produtos de Saúde, I. P., com a operacionalização da Deliberação n.º 395-A/2025, de 14 de março (1).
(1) DR 52/2025, Sup., 2ª, 14.03.2025

INFARMED pretende reforçar equipa de peritos da CAM e da CATS
Conforme noticiado a 24 de fevereiro, o INFARMED pretende integrar novos peritos na Comissão de Avaliação de Tecnologias de Saúde (CATS) assim como na Comissão de Avaliação de Medicamentos, de acordo com as necessidades atuais e futuras.
A CAM é um órgão consultivo especializado ao qual compete emitir pareceres em matérias relacionadas com medicamentos, designadamente no domínio da avaliação da qualidade, eficácia e segurança, bem como sobre quaisquer outros assuntos de carácter técnico-científico. Para saber como reforçar esta Comissão clique aqui.
A CATS é uma comissão especializada à qual compete emitir pareceres e recomendações em diversas áreas farmacoterapêuticas, bem como apreciar estudos de avaliação económica no âmbito do Sistema Nacional de Avaliação de Tecnologias de Saúde (SiNATS). Para saber como reforçar esta Comissão
clique aqui.

Infarmed e Instituto Superior Técnico assinam protocolo de colaboração
A Autoridade Nacional do Medicamento e Produtos de Saúde (INFARMED, I.P.) e o Instituto Superior Técnico (IST) assinam protocolo de colaboração com o objetivo de reforçar a cooperação técnico-científica e promover o desenvolvimento de projetos conjuntos na área de sistemas de informação aplicados às atividades de regulação e avaliação de tecnologias de saúde.
O presente protocolo identifica áreas prioritárias, designadamente sistemas de monitorização da utilização de dispositivos médicos nos estabelecimentos de saúde e sistemas de apoio às atividades de avaliação farmacoterapêutica e económica de medicamentos e de outras tecnologias de saúde. Prevê, ainda, a possibilidade de realização de estudos avançados de alunos do IST em áreas de interesse do Infarmed.
O Infarmed tem apostado na construção de parcerias estratégicas com as entidades do sistema científico e tecnológico. Na sessão do 32.º Aniversário do Infarmed, Rui Santos Ivo, reafirmou o compromisso do instituto para com a modernização administrativa e a agenda para a transição digital, em linha com as orientações estratégicas do XXVI Governo.
Saiba mais aqui.

Medicamentos de terapias avançadas não regulamentados representam riscos graves para a saúde
A Agência Europeia de Medicamentos (EMA) e os Chefes das Agências do Medicamento (HMA) lançaram um alerta para os perigos dos Medicamentos de Terapias Avançadas (ATMP) não regulamentados, que estão a ser vendidos a doentes na União Europeia (UE).
Os ATMP são medicamentos baseados em genes, tecidos ou células. Quando estes medicamentos são devidamente regulamentados (isto é, autorizados pela EMA ou aprovados por uma autoridade nacional), podem trazer benefícios importantes para os doentes. A UE estabeleceu diretrizes rigorosas para garantir que os ATMP cumprem elevados padrões de segurança e eficácia.
No entanto, vários indivíduos, empresas e clínicas têm comercializado ATMP não regulamentados diretamente aos doentes, muitas vezes sem estudos sobre a sua eficácia, qualidade e segurança. Um dos exemplos é a comercialização de terapias com células dendríticas, que utilizam um tipo de célula do sistema imunitário (células dendríticas) para atacar células cancerígenas.
As autoridades alertam que estes produtos não regulamentados podem colocar os doentes em risco, causando efeitos secundários graves sem oferecer benefícios reais.
Saiba mais aqui.

Comissão Europeia apresenta Lei de Medicamentos Críticos (Critical Medicines Act)
A Comissão Europeia apresentou a Lei de Medicamentos Críticos (Critical Medicines Act), uma iniciativa que tem como objetivo identificar e mitigar vulnerabilidades nas cadeias de fabrico e abastecimento e apoiar a produção de medicamentos e matérias-primas, a fim de reforçar a autonomia estratégica e a disponibilidade de medicamentos críticos a nível europeu.
A proposta da Comissão Europeia reconhece que a escassez de medicamentos é causada sobretudo por problemas de fabrico e pela complexidade e vulnerabilidades das cadeias globais de abastecimento.
No final de fevereiro, a Critical Medicines Alliance publicou um relatório com recomendações concretas para uma abordagem mais coordenada na União Europeia (UE).
Rui Santos Ivo, Presidente do Conselho Diretivo do INFARMED, destaca a importância da Lei de Medicamentos Críticos para “a promoção de uma abordagem europeia coordenada que garanta a disponibilidade de medicamentos, e dos medicamentos essenciais em particular” destacando que “este é um tema estratégico e crucial para a Europa e que preocupa as autoridades reguladoras, que têm promovido e acompanhado o desenvolvimento de instrumentos, ferramentas e medidas para a mitigação e prevenção de situações de escassez”.
Saiba mais aqui.

Infarmed recebe Embaixador de Cuba no âmbito da cooperação bilateral na área do medicamento
O Infarmed – Autoridade Nacional do Medicamento e Produtos de Saúde, I.P. recebeu esta segunda-feira, dia 17 de março, na sua sede em Lisboa, o Embaixador de Cuba em Portugal, José Ramón Saborido Loidi.
O encontro contou com a presença do Presidente do Conselho Diretivo do Infarmed, Rui Santos Ivo, e teve como objetivo o aprofundamento das relações bilaterais entre os dois países na área do medicamento e produtos de saúde, nomeadamente no âmbito do Memorando de Entendimento assinado entre o Infarmed e o Centro de Controlo Estatal dos Medicamentos, Equipamentos e Dispositivos Médicos (CECMED), a autoridade reguladora cubana.
O Memorando, firmado em maio de 2024, visa promover e desenvolver a cooperação regulamentar entre as duas entidades, reforçando a confiança mútua e fomentando a partilha de conhecimentos e experiências no domínio da regulação do medicamento e dos dispositivos médicos. Durante a reunião, foram debatidas formas de implementação das iniciativas previstas no acordo, oportunidades para o intercâmbio de boas práticas e a colaboração técnica em áreas de interesse comum e, ainda, o aprofundamento da cooperação entre a indústria farmacêutica nacional e a indústria farmacêutica cubana.
“Este encontro reforça o compromisso de cooperação entre Portugal e Cuba, promovendo a partilha de boas práticas regulatórias essenciais para a segurança e qualidade dos medicamentos e produtos de saúde num contexto de saúde global”, afirma Rui Santos Ivo.
O diplomata cubano aproveitou a ocasião para dirigir ao Infarmed o convite para a participação na V Convenção Internacional de Saúde “Cuba Saúde 2025” que ocorre entre os dias 21 a 25 de abril, em Havana. Neste âmbito, o CECMED organiza o Simpósio “Incentivar a produção local através de regulação mais eficiente”, uma iniciativa especificamente dirigida às autoridades reguladoras do medicamento e à indústria farmacêutica.
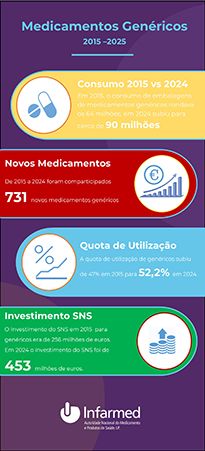
Utilização de Medicamentos Genéricos em Portugal
Os medicamentos genéricos em Portugal, como em qualquer parte do mundo, desempenham um papel fundamental na acessibilidade dos cidadãos com doença aos tratamentos, contribuindo ainda para a redução da despesa do Estado e dos utentes com medicamentos.
Ao longo dos últimos anos a utilização de medicamentos genéricos em Portugal tem vindo a aumentar consideravelmente. Em 2015 o consumo anual destes medicamentos rondava os 64 milhões de embalagens dispensadas, evoluindo para cerca de 90 milhões em 2024.
Durante o mesmo período de 10 anos, foram comparticipados 731 novos medicamentos genéricos.
A utilização dos medicamentos genéricos em Portugal tem registado uma constante evolução positiva, desde os 47% em 2015 houve um aumento superior a cinco pontos percentuais, registando-se no final de 2024 uma utilização de 52,2%, um valor nunca antes registado no nosso país. De salientar que este valor é medido no ‘mercado total’, ou seja, tendo em conta a comercialização do total de medicamentos, mesmos para aqueles em que não existem ainda genéricos disponíveis. Se contabilizarmos apenas o mercado em que os medicamentos de referência (ou marca) apresentam pelo menos um genérico, o valor de utilização destes medicamentos situa-se atualmente nos 64,9% o que atesta bem não só a grande disponibilidade de medicamentos genéricos no nosso país, como a confiança que os portugueses neles depositam.
Saiba mais aqui.

Informamos ainda que…
- No momento em que cessa funções, como Diretora da Direção de Avaliação das Tecnologias de Saúde (DATS), o Conselho Diretivo do INFARMED expressou um louvor público à Dr.ª Cláudia Furtado, agradecendo e reconhecendo profundamente o seu esforço, dedicação, competência, responsabilidade e sentido de missão e de compromisso com o serviço público, demonstrados no exercício da função de Diretora da referida Direção, onde deixa uma marca significativa, refletindo um exemplo de excelência. A Dr.ª Cláudia Furtado continuará a exercer as suas funções como Diretora da Direção de Informação e Planeamento Estratégico do INFARMED, cargo que já exercia a par da Direção da DATS.
- Foi disponibilizado um mapa interativo, de ensaios clínicos, no portal público do Sistema de Informação de Ensaios Clínicos (CTIS). Este mapa permite aos utilizadores a visualização e pesquisa de ensaios clínicos, em tempo real, por indicação em estudo, e pela localização onde o ensaio está a decorrer na União Europeia, assim como o estado de recrutamento. No dia 7 de março de 2025 será realizado um webinar público, com a demonstração ao vivo de todas as funcionalidades deste novo mapa.
- A CEIC – Comissão de Ética para a Investigação Clínica irá celebrar o seu 20.º aniversário com uma sessão comemorativa a realizar no próximo dia 28 de março de 2025, pelas 9h00, na Sala dos Atos da Nova Medical School, Campo Mártires da Pátria, em Lisboa. Inscrições e programa a disponibilizar brevemente. Para mais informações, contacte ceic@ceic.pt.
- Foi publicada a Deliberação n.º 234/2025, de 18 de fevereiro, que aprova o Regulamento sobre o controlo de transações de medicamentos para o exterior do país e atualiza os fatores para a elaboração da lista de notificação prévia (LNP) e da lista de medicamentos com exportação ou distribuição temporariamente suspensa. Para mais informações, consulte a área do Controlo da Disponibidade.
- A Comissão Europeia deu início a uma consulta pública e a um pedido de contributos relativamente aos regulamentos europeus 2017/745 sobre dispositivos médicos e 2017/746 sobre dispositivos médicos para diagnóstico in vitro. Os comentários e contributos no âmbito da consulta pública podem ser submetidos até 21 de março de 2025, através desta ligação no site da Comissão Europeia.

Financiamento Público de Medicamentos
Este espaço pretende divulgar os medicamentos com financiamento público aprovado recentemente, que enriquecem o arsenal terapêutico disponível a nível nacional. Pode aceder ao Relatório Público de Avaliação clicando no nome do medicamento.
| Tebentafusp | – Deferido a 10-03-2025. KIMMTRAK é indicado como monoterapia para o tratamento de doentes adultos positivos para o antigénio leucocitário humano (HLA)-A*02:01 com melanoma uveal irressecável ou metastático. |
| Atezolizumab | – Deferido a 10-03-2025. Tratamento adjuvante do cancro do pulmão de não pequenas células com elevado risco de recidiva e PD-L1>50%. |
| Gálio (68Ga) gozetotido | – Deferido a 10-03-2025. Após marcação radioativa com gálio-68, é indicado para deteção de lesões positivas para o antigénio de membrana específico da próstata (PSMA, prostate-specific membrane antigen) com tomografia de emissão de positrões (PET) em adultos com cancro da próstata (CP) nos seguintes contextos clínicos: Estadiamento primário de doentes com CP de risco elevado, antes da terapêutica curativa primária; Suspeita de recidiva de CP em doentes com aumento dos níveis séricos de antigénio específico da próstata (PSA), após terapêutica curativa primária; Identificação de doentes com progressão do cancro da próstata resistente à castração metastático (CPRCm) positivo para o PSMA, para os quais seja indicada terapêutica dirigida ao PSMA. |
| Miglustato | – Deferido a 10-03-2025. Pombiliti (cipaglucosidase alfa) é uma terapêutica de substituição enzimática a longo prazo utilizada em combinação com o estabilizador de enzimas miglustato para o tratamento de adultos com doença de Pompe de início tardio (deficiência de αglucosidase ácida [GAA]). |
| Cipaglucosidase alfa | – Deferido a 10-03-2025. Pombiliti (cipaglucosidase alfa) é uma terapêutica de substituição enzimática a longo prazo utilizada em combinação com o estabilizador de enzimas miglustato para o tratamento de adultos com doença de Pompe de início tardio (deficiência de αglucosidase ácida [GAA]). |
| Ibrutinib | – Deferido a 15-01-2025. Em associação com rituximab para o tratamento de doentes adultos com macroglobulinemia de Waldenström. |
| Ibrutinib | – Deferido a 15-01-2025. IMBRUVICA, em associação com venetoclax é indicado para o tratamento de doentes adultos com leucemia linfocítica crónica (LLC) não tratados previamente. |
| Dupilumab | – Deferido a 09-01-2025. Tratamento da dermatite atópica grave em crianças dos 6 meses aos 5 anos de idade que são candidatas a terapêutica sistémica. |
| Dupilumab | – Deferido a 09-01-2025. Tratamento complementar de manutenção para asma grave com inflamação tipo 2 caracterizada por eosinófilos elevados no sangue e/ou fração exalada de óxido nítrico (FeNO) aumentada, que são inadequadamente controlados com doses médias a elevadas de corticosteróides inalados (ICS) associados a outro medicamento para tratamento de manutenção, em idades entre os 6 e os 11 anos |
| Dupilumab | – Deferido a 09-01-2025. Dupixent é indicado para o tratamento da esofagite eosinofílica em adultos e adolescentes com idade igual ou superior a 12 anos, com peso igual ou superior a 40 kg, inadequadamente controlados, intolerantes ou não candidatos à terapêutica medicamentosa convencional. |
| Oritavancina | – Deferido a 09-01-2025. Tratamento de infeções bacterianas agudas cutâneas e das estruturas cutâneas em adultos |
| Midazolam | – Deferido a 09-01-2025. Tratamento de convulsões agudas e prolongadas em lactentes, crianças e adolescentes (desde os 3 meses até menos de 18 anos de idade). |

Serviços Online / Aplicações móveis
De forma a facilitar a pesquisa de informação por parte do cidadão, o INFARMED disponibiliza no seu website e nas plataformas Android e iOS, algumas aplicações nas suas áreas de competência, das quais destacamos:
| Infomed – Base de dados nacional de medicamentos de uso humano. |
|
 |
Portal RAM - Portal de notificação de suspeitas de reações adversas a medicamentos, do Sistema Nacional de Farmacovigilância (SNF). |
 |
Poupe na Receita – Saiba o preço dos seus medicamentos. Disponível na Play Store, App Store e AppGallery. |

Legislação
Este segmento da INFARMED Newsletter divulga a seleção das últimas alterações de legislação, relevantes para a atividade do INFARMED, publicadas em Diário da República e Jornal Oficial da União Europeia.
Diário da República
Lei n.º 23/2025 - Diário da República n.º 47/2025, Série I de 2025-03-07 - Inclui novas substâncias psicoativas na definição de droga, alterando o Decreto-Lei n.º 15/93, de 22 de janeiro, que aprova o regime jurídico aplicável ao tráfico e consumo de estupefacientes e substâncias psicotrópicas.
Portaria n.º 82/2025/1 - Diário da República n.º 44/2025, Série I de 2025-03-04 - Cria o regime excecional de comparticipação de tecnologias de saúde para a nutrição entérica.
Portaria n.º 84/2025/1 - Diário da República n.º 45/2025, Série I de 2025-03-05 - Aprova o Regulamento do Controlo Metrológico Legal dos Instrumentos de Medição e Registo da Temperatura.
Despacho n.º 3143/2025 - Cria o grupo de trabalho com a missão de avaliar o modelo de financiamento e monitorização do acesso a medicamentos inovadores, tendo em vista a identificação de desafios e a apresentação de propostas de solução que garantam a equidade no acesso, a sustentabilidade financeira e a melhoria da eficiência do Serviço Nacional de Saúde (SNS).
Despacho n.º 3030/2025 - Diário da República n.º 47/2025, Série II de 2025-03-07 - Designa a SPMS ― Serviços Partilhados do Ministério da Saúde, E. P. E., para coordenar os trabalhos preparatórios tendentes à implementação do Regulamento Europeu do Espaço de Dados em Saúde.
Jornal Oficial da União Europeia
Regulamento (UE) 2025/327 do Parlamento Europeu e do Conselho, de 11 de fevereiro de 2025, relativo ao Espaço Europeu de Dados de Saúde e que altera a Diretiva 2011/24/UE e o Regulamento (UE) 2024/2847, (Texto relevante para efeitos do EEE)

