
Reunião EPSCO junho 2023
O Conselho EPSCO reuniu-se durante os dias 12 e 13 de junho, com os assuntos relacionados com a saúde a serem debatidos no segundo dia do encontro.
Rui Santos Ivo, Presidente do INFARMED, acompanhou a comitiva portuguesa, liderada pelo Ministro da Saúde, Manuel Pizarro.
O Conselho adotou uma recomendação destinada a intensificar a ação da UE para combater a resistência aos antimicrobianos (RAM) nos domínios da saúde humana, da saúde animal e do ambiente, através da abordagem "Uma Só Saúde". Foram definidas metas para reduzir a utilização dos antimicrobianos até 2030.
Foram ainda definidas as orientações gerais para um regulamento, que tem como objetivo modernizar e simplificar a estrutura de taxas a pagar à Agência Europeia de Medicamentos (EMA). O diploma terá como finalidade assegurar que as taxas cobradas pela EMA são baseadas nos custos, bem como reduzir a complexidade do atual quadro jurídico.
O Conselho contou ainda com uma discussão em torno do ecossistema farmacêutico europeu e sobre a revisão da Legislação Farmacêutica. O Ministro Manuel Pizarro referiu que "Necessitamos de mais Europa e de cooperação entre os nossos Estados Membros, de outro modo não será possível aos nossos países ter acesso à inovação", pelo que Portugal apoia a revisão da Legislação Farmacêutica na UE.
Entre outros assuntos a Presidência e a Comissão informaram as delegações presentes das negociações em curso, relativas a um acordo internacional sobre prevenção, preparação e resposta a pandemias, bem como de alterações complementares ao Regulamento Sanitário Internacional e também, sobre os progressos realizados até à data no que respeita ao regulamento relativo à criação de um Espaço Europeu de Dados de Saúde (EEDS).

2ª reunião plenária da EDQM Borderline Products Network
A Agência de Medicamentos Suíça (Swissmedic) recebeu, nos passados dias 31 de maio e 1 de junho, a 2ª reunião plenária da EDQM borderline Products Network da qual fazem parte Eva Mendes, Chair do comité CD-P-PH/PC (Committee of Experts on Quality and Safety Standards in Pharmaceutical Practices and Pharmaceutical Care) e Ana Paula Martins, ambas da Direção de Avaliação de Medicamentos do INFARMED.
Esta rede, estabelecida sob a égide do CD-P-PH (European Committee on Pharmaceuticals and Pharmaceutical Care) da EDQM visa a partilha
entre os membros do Conselho da Europa, de informação e de procedimentos referentes aos produtos fronteira (produtos que não têm status claro e, nesse sentido, não se enquadram em categorias regulamentares específicas).
Durante a reunião, foram abordados diversos tópicos, entre os quais, a venda transnacional de produtos fronteira em plataformas online (ex. Amazon), cooperação com os OMCL, cooperação nacional com outras autoridades (ex. Alfandegas) nos vários Estados Membros, etc. Adicionalmente, Eva Mendes fez uma apresentação sobre o projecto “Safe Use of Herbal Food Supplements: Information about Appropriate Use and Possible Risks” que está a ser desenvolvido pelo Comité de peritos CD-P-PH/PC.
O evento contou com a presença de peritos de cerca de 20 países, que durante 1 dia e meio partilharam as suas experiências e discutiram possíveis caminhos comuns para abordar e lidar com este tipo de produtos, visando sempre a proteção da saúde pública.

Declaração conjunta do ECDC e EMA sobre a atualização da composição das vacinas COVID-19 para novas variantes do vírus SARS-CoV-2
O Centro Europeu de Prevenção e Controle de Doenças (ECDC) e a Agência Europeia de Medicamentos (EMA) publicaram uma atualização sobre a adaptação das vacinas COVID-19 autorizadas, tendo em vista a sua utilização durante a próxima campanha de vacinação do outono de 2023.
As vacinas COVID-19 atualmente autorizadas na União Europeia (UE) incluem as seguintes variantes: Wuhan monovalente (vacina original), bivalente Wuhan/Omicron BA.1, bivalente Wuhan/Omicron BA.4/5, Beta monovalente (B.1.351) e bivalente Beta (B.1.351) Alfa (B.1.1.7).
Os dados de eficácia e efetividade disponíveis mostram que as vacinas COVID-19 atualmente aprovadas, incluindo aquelas baseadas no vírus inicial (Wuhan), continuam a fornecer proteção contra doença grave, hospitalização e morte. No entanto, os mesmos dados indicam que a proteção diminui com o tempo e à medida que o vírus sofre mutações para variantes imunologicamente distantes das variantes incluídas nas vacinas.
Os Membros da Coalizão Internacional de Autoridades Reguladoras de Medicamentos (ICMRA), juntamente com a Organização Mundial de Saúde (OMS), reuniram-se no passado dia 8 de maio; por sua vez, o Grupo Consultivo Técnico da OMS sobre a Composição das Vacinas COVID-19 (TAG-CO-VAC) reuniu-se nos dias 11 e 12 de maio, tendo emitido uma declaração a 18 de maio com as suas conclusões. Em ambas as reuniões, foi unânime a conclusão de que existe necessidade de atualizar a composição das vacinas COVID-19. Ambos os grupos concluíram que o vírus SARS-CoV-2 parece continuar a evoluir, divergindo do vírus inicial e que enquanto se aguarda por dados adicionais, as vacinas monovalentes, contendo a sublinhagem da Ómicron XBB, podem ser consideradas uma escolha razoável para a campanha de vacinação do outono de 2023, a fim de melhorar a respostas imunológica induzida pela vacina às variantes de SARS-CoV-2 atualmente em circulação e tendo em consideração o elevado nível de imunidade já existente na população contra a estirpe ancestral e as outras estirpes previamente circulantes.
Com base em dados de vigilância e sequenciação, predominam atualmente a nível global, incluindo nos países da UE, linhagens descendentes da linhagem XBB.1 (ou seja, XBB.1.5, XBB.1.16, XBB.1.9).
Para mais informações, aceda ao comunicado original.
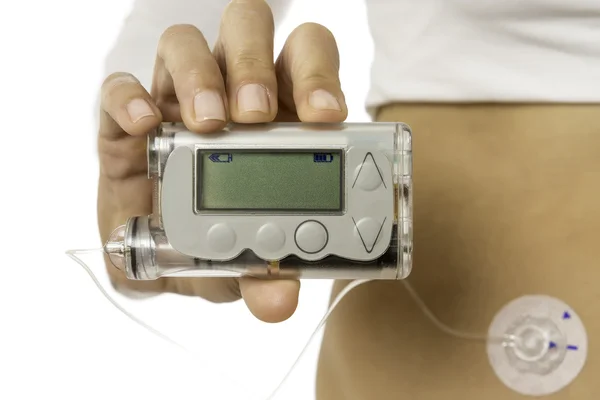
Programa de acesso universal a bombas de insulina de nova geração
O Ministério da Saúde vai implementar, a partir deste ano, um programa de acesso a bombas de insulina de nova geração no Serviço Nacional de Saúde, garantindo a disponibilização destes aparelhos a todos os potenciais beneficiários até 2026. O novo programa vai funcionar sob orientação da Direção Executiva do SNS (DE-SNS), com o envolvimento da Direção-Geral da Saúde (DGS) e demais organismos competentes, tendo sido estabelecido um prazo de 120 dias para a sua operacionalização.
O Governo dá assim seguimento às recomendações do grupo de trabalho, nomeado em novembro de 2022, que o Infarmed também integrou, que estimou que atualmente 15 mil pessoas com diabetes tipo 1 em Portugal podem beneficiar dos aparelhos de nova geração, comprometendo-se a fazer chegar a tecnologia a todas as pessoas elegíveis do ponto de vista clínico.
Os Sistemas de Administração Automática de Insulina (SAAI), mais conhecidos como bombas de insulina automáticas, garantem maior conforto e segurança na administração de insulina, favorecendo um maior controlo da glicemia e permitindo uma maior funcionalidade destas pessoas, pelo que esta resposta contribuirá para a melhoria da qualidade de vida de um grupo significativo de cidadãos.
Os Serviços Partilhados do Ministério da Saúde, EPE (SPMS), em estreita articulação com o INFARMED, IP e com o Serviço de Utilização Comum dos Hospitais (SUCH), terão agora de desenvolver uma estratégia de compras públicas transparente e eficaz, que garanta a incorporação da tecnologia no arsenal de dispositivos médicos comparticipados pelo Serviço Nacional de Saúde a custos unitários consentâneos com o volume de utilização.
Mais informação, poderá ser consultada no Portal do SNS.

Boas práticas para a prevenção de ruturas de abastecimento
A rede composta pelo Grupo dos Chefes das Agências de Medicamentos (HMA) e a Agência Europeia de Medicamentos (EMA) publicaram recomendações para a indústria contendo boas práticas para assegurar a continuidade do abastecimento de medicamentos, prevenir ruturas e reduzir o seu impacto na saúde dos doentes.
O documento contém dez recomendações para titulares de autorização de introdução no mercado, fabricantes e distribuidores por grosso, para minimizar a ocorrência de ruturas de medicamentos. As recomendações incluem informar as autoridades nacionais competentes sobre a rutura, potencial ou real, com a maior antecipação possível, e fornecer informações detalhadas para permitir prever o impacto na saúde pública e implementar medidas preventivas; estabelecer planos robustos de prevenção e gestão da escassez; otimizar os sistemas de qualidade farmacêutica e aumentar a resiliência das cadeias de abastecimento, cada vez mais complexas e multinacionais; comunicar atempadamente com os vários intervenientes na cadeia de abastecimento de medicamentos e estabelecer princípios gerais para promover a distribuição justa e equitativa de medicamentos para responder às necessidades dos doentes.
As recomendações são baseadas na análise das causas das ruturas e na experiência dos reguladores na coordenação da gestão destas situações e consulta às associações do setor.
A Task Force HMA/EMA é coordenada conjuntamente por HMA e EMA e integra o INFARMED, I.P.

25 Anos do Colégio de Especialidade em Assuntos Regulamentares
Para assinalar os 25 anos da criação da especialidade em Assuntos Regulamentares, o Conselho do Colégio de Especialidade de Assuntos Regulamentares da Ordem dos Farmacêuticos organizou no dia 2 de junho uma Sessão Comemorativa que se realizou no Museu do Oriente, em Lisboa. Na comemoração dos 25 anos, alguns farmacêuticos especialistas que trabalham no INFARMED foram convidados a dar a sua perspetiva sobre as mudanças a nível da atividade regulamentar através de testemunhos vídeo.
Rui Santos Ivo, Presidente do INFARMED, foi convidado para uma apresentação sobre o futuro dos Assuntos Regulamentares, onde teve a oportunidade de partilhar com os farmacêuticos especialistas em Assuntos Regulamentares a sua perspetiva sobre os principais desafios futuros para o ecossistema farmacêutico e da saúde, bem como as principais tendências. Assinalou, igualmente, alguns dos aspetos mais relevantes e impactantes da proposta de reforma da Legislação Farmacêutica apresentada pela Comissão Europeia.

Painéis de Peritos de Dispositivos Médicos - O que são e para que servem
Os novos regulamentos (DM e DIV) visam garantir que dispositivos médicos seguros e com adequado desempenho sejam colocados no mercado da União Europeia (UE), ao mesmo tempo em que apoiam a inovação.
Contêm melhorias importantes, entre as quais um controlo mais rigoroso de dispositivos de alto risco por meio de um novo mecanismo de escrutínio pré-mercado, reforço das regras relativas à evidência clínica e maior transparência. Para este efeito foram criados órgãos científicos, nomeadamente painéis de peritos, laboratórios especializados e Laboratórios de Referência da UE (EURL). Estes órgãos têm como funções, facultar aconselhamento científico e técnico à Comissão Europeia, aos Estados-Membros, aos organismos notificados e aos fabricantes, contribuir para orientações e outros documentos relevantes e identificar questões emergentes que possam constituir motivo de preocupação relativamente a dispositivos médicos (DM) e dispositivos médicos para diagnóstico in vitro (DIV).
Em particular, os painéis de peritos foram estabelecidos pela Comissão Europeia, para apoiar a avaliação científica e aconselhamento científico na área de DM e DIV.
Os membros dos referidos painéis são peritos de alto gabarito nas suas próprias áreas nomeados pela Comissão Europeia, na sequência de convite à manifestação de interesse, com base nos seus conhecimentos científicos, clínicos e técnicos. Estes painéis reúnem mais de 200 especialistas de toda a UE, garantindo a diversidade de abordagens científicas e clínicas, distribuindo-se em várias categorias.
Mais informação poderá ser consultada no website da Comissão Europeia.

Informamos ainda que…
- No âmbito das celebrações dos seus 30 anos, o Infarmed organiza um Fórum dedicado aos Reguladores, no dia 4 de julho de 2023, das 10:30 às 16:45, no Hotel Mar d'Ar Muralhas, em Évora, em modo presencial. Neste Fórum pretende-se discutir o papel do regulador, a regulação em saúde, aprofundando contextos como a transformação digital, a importância dos processos colaborativos entre entidades reguladoras e os desafios específicos da regulação na área do medicamento e dos produtos de saúde. Inscreva-se!
- O INFARMED iniciou no mês de maio a 1ª vaga da campanha nas redes sociais da instituição, que visa reforçar a divulgação das animações no âmbito da literacia em saúde. Esta ação insere-se no plano de comemorações do 30º aniversário e irá dar nova visibilidade às 8 animações já existentes dirigidas ao público em geral. Esta campanha, que consiste na partilha de posts no LinkedIn, Facebook e Twitter, com link direto para as diferentes animações, será constituída por três fases: maio/junho, setembro/outubro e novembro/dezembro. Ao todo serão feitos 72 posts nas três páginas das redes sociais do Infarmed.
- No âmbito do seu 30º aniversário o website do INFARMED disponibiliza uma área temática onde poderá aceder à sessão inaugural da comemoração, à agenda dos eventos e onde pode também conhecer mais sobre a história da instituição.

Serviços Online / Aplicações móveis
De forma a facilitar a pesquisa de informação por parte do cidadão, o INFARMED disponibiliza no seu website e nas plataformas Android e iOS, algumas aplicações nas suas áreas de competência, das quais destacamos:
| Infomed – Base de dados nacional de medicamentos de uso humano. |
|
 |
Portal RAM - Portal de notificação de suspeitas de reações adversas a medicamentos, do Sistema Nacional de Farmacovigilância (SNF). |
 |
Poupe na Receita – Saiba o preço dos seus medicamentos. Disponível na Play Store, App Store e AppGallery. |

Legislação
Este segmento da INFARMED Newsletter divulga a seleção das últimas alterações de legislação, relevantes para a atividade do INFARMED, publicadas em Diário da República e Jornal Oficial da União Europeia.
Diário da República
Despacho n.º 6440/2023 - Determina a criação de um programa integrado de tratamento das pessoas com diabetes mellitus tipo 1, através da colocação de Sistemas de Administração Automática de Insulina (SAAI) a todas as que tenham indicação e motivação para tal, com desenvolvimento progressivo nos anos de 2023 a 2026
Portaria n.º 160/2023 - Estabelece a lista de medicamentos manipulados comparticipados a que se refere o n.º 5 do artigo 22.º do Decreto-Lei n.º 97/2015, de 1 de junho, na sua redação atual.
Resolução do Conselho de Ministros n.º 50/2023 - Autoriza a despesa com a aquisição de vacinas e tuberculinas no âmbito do Programa Nacional de Vacinação para o ano de 2023.
Despacho n.º 6386/2023 - Altera os n.os 11 e 24 do Despacho n.º 10901/2022, de 2 de setembro, publicado no Diário da República, 2.ª série, n.º 174, de 8 de setembro de 2022, que atualiza o Programa de Prevenção e Controlo de Infeções e de Resistência aos Antimicrobianos
Jornal Oficial da União Europeia
Notificação ao Comité Misto Setorial pela União Europeia ao abrigo do artigo 7.o do Anexo Setorial sobre Boas Práticas de Fabrico de Medicamentos ("BPF") do Acordo sobre Reconhecimento Mútuo entre a Comunidade Europeia e os Estados Unidos da América

