
Brexit: Portugal assume novas responsabilidades relativas à introdução de medicamentos no mercado
Com a aproximação do Brexit, Portugal aceitou a responsabilidade de, no final de março, assumir os processos autorização de introdução no mercado europeu de medicamentos nos quais era co-relator com o Reino Unido. Esta medida foi tomada no encontro bianual de presidentes dos Conselhos Diretivos das diferentes autoridades nacionais do medicamento europeias, que decorreu entre os dias 20 e 22 de fevereiro, na Roménia.
Um dos temas em destaque neste encontro, e que tem sido recorrente pela importância que reveste, é o do impacto do Brexit na circulação de medicamentos no espaço europeu e a necessidade de adaptação da União Europeia à saída do Reino Unido, no que concerne a todas as matérias relacionadas com o abastecimento e autorização de introdução no mercado de medicamentos e produtos de saúde.
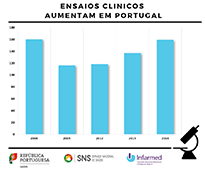
Ensaios clínicos aumentam em Portugal em 2018
Em 2018 foram submetidos, em Portugal, 159 pedidos de autorização de ensaios clínicos, mais 16 por cento do que em 2017, praticamente igualando o máximo histórico de 160 pedidos de 2006. Os medicamentos envolvidos são predominantemente biotecnológicos de terapia avançada.
Os principais hospitais onde se realizaram estes ensaios clínicos são o Centro Hospitalar e Universitário de Coimbra, E.P.E., o Centro Hospitalar de Lisboa Norte - Hospital De Santa Maria, E.P.E., o Centro Hospitalar Lisboa Ocidental - Hospital de Egas Moniz e o Centro Hospitalar De S. João, E.P.E.
O aumento que hoje verificamos, deve-se sobretudo a uma mudança do paradigma no processo negocial com a indústria farmacêutica, na comparticipação de medicamentos, baseada no “dossier-empresa” – que identifica o investimento em investigação, entre outros fatores.
O Infarmed está a criar mais mecanismos para acompanhar os dossiês dos ensaios e brevemente será implementado na União Europeia um novo Regulamento, ao qual se associará uma plataforma informática, que visa também uniformizar, simplificar e agilizar os procedimentos de autorização de ensaios clínicos na União. O regulamento irá centralizar todo o processo de submissão e tornar a Europa um espaço mais atrativo no que concerne à inovação e investigação científicas a nível global.
Esta política é reforçada com a entrada de Portugal na rede europeia de investigação de translação EATRIS (European Infrastructure for Translational Medicine) através do Infarmed. A Autoridade do Medicamento é também um dos sócios fundadores da Agência de Investigação Clínica e Inovação Biomédica (AICIB) e este posicionamento reflete um esforço concertado para aumentar os ensaios clínicos nos hospitais e nos centros de saúde.

O Comité Técnico de La Valletta reuniu pela sétima vez em Zagreb
O Comité Técnico de La Valletta (VTC), que teve a sua origem na Declaração de La Valletta, em 2017, com a participação de dez países europeus para garantir o acesso aos doentes a medicamentos inovadores e a sustentabilidade dos sistemas de saúde, reuniu-se, pela sétima vez, entre 28 de fevereiro e 1 de março, em Zagreb.
Esta reunião teve como agenda o intercâmbio de informações comparáveis sobre preço de medicamentos, a seleção de novos medicamentos e a cooperação sustentável e eficaz. Teve lugar ainda o debate sobre as abordagens para a avaliação e uso de terapias com células T CAR, pelos diferentes sistemas nacionais de saúde.
Do VTC fazem parte a Itália, Portugal, Croácia, Malta, Chipre, Grécia, Irlanda, Roménia, Eslovénia, Espanha.

Projeto Berc-Luso é recebido pelas embaixadas de Moçambique, Guiné-Bissau, Angola e Cabo Verde e marca simpósio para junho em Lisboa
O projeto Berc Luso, de Ética e Reforço da Capacitação Regulamentar na área dos medicamentos e produtos de saúde, desenvolvido nos quatro de expressão Portuguesa, Angola, Guiné-Bissau, Moçambique e Cabo Verde, foi recebido ao mais alto nível nas embaixadas Portuguesas de Moçambique e Guiné-Bissau.
A newsletter n.º 5 do projeto Berc-Luso descreve testemunhos do Embaixador Joaquim Simeão Casimiro Bule e de Bacar Sanhá, Diplomata da Guiné-Bissau, reiterando a disponibilidade em participar e facilitar todo o acesso a informação, destacando os benefícios do projeto, de reestruturação e harmonização dos recursos nestes países com vista à melhoria das condições de desburocratização dos processos relacionados com os medicamentos nos seus países, para a estabilização da área da industria farmacêutica e de produtos de saúde nas suas economias.
Os representantes das embaixadas de Angola e de Cabo-Verde reuniram na Ordem dos Farmacêuticos também ao abrigo deste projeto, para apreciação de um Simpósio Berc-Luso que está já marcado para 6 de junho no auditório do Infarmed, em Lisboa

Legislação
Este segmento da Infarmed Newsletter, divulga a seleção das últimas alterações de legislação, relevantes para a atividade do Infarmed, publicadas em Diário da República e Jornal Oficial da União Europeia:
DIÁRIO DA REPÚBLICA
Resolução da Assembleia da República n.º 30/2019 - Planeamento de recursos humanos no sector da saúde
Portaria n.º 70/2019 - Alteração da Portaria n.º 131/2017, de 7 de abril, retificada pela Declaração de Retificação n.º 15/2017, de 27 de abril
Despacho n.º 1890-A/2019 - Concede tolerância de ponto aos trabalhadores que exercem funções públicas nos serviços da administração direta do Estado, sejam eles centrais ou desconcentrados, e nos institutos públicos, no dia 5 de março de 2019
Aviso n.º 2953/2019 - Autorização para aquisição direta de substâncias estupefacientes, psicotrópicas e seus preparados concedida à entidade Camelo Ferreira, Lda., no âmbito do desenvolvimento das suas atividades de prevenção, diagnóstico, tratamento das anomalias e doenças dos dentes, boca, maxilares e estruturas anexas, ao abrigo da Deliberação do Conselho Diretivo do Infarmed n.º 98/CD/2014 de 30 de julho, sendo a aquisição direta limitada às substâncias Diazepam e Midazolam, nas suas instalações sitas na Urbanização do Barrocal, Lote 59, R/C, Loja B, 8365-204 Pêra, Silves
Aviso n.º 2954/2019 - Autorização para fabrico de substâncias estupefacientes, psicotrópicas e seus preparados concedida à entidade Instituto de Soldadura e Qualidade, nas suas instalações sitas no Tagus Park - Parque de Ciência e Tecnologia de Oeiras, Avenida Professor Doutor Cavaco Silva, n.º 33, 2740-120 Porto
Aviso n.º 3066/2019 - Autorização para comercializar por grosso e importar substâncias estupefacientes, psicotrópicas e seus preparados concedida à entidade Belphar, Lda., nas suas instalações sitas no Edifício Logista, Expansão Área Industrial do Passil, Lote 1A, Palhavã, 2894-002 Alcochete
Aviso n.º 3067/2019 - Autorização para comercializar por grosso, importar, exportar e trânsito de substâncias estupefacientes, psicotrópicas e seus preparados concedida à entidade Scripnoli Unipessoal, Lda., nas suas instalações sitas no Centro Empresarial da Rainha, Lote 27, 2050-501 Vila Nova da Rainha
Aviso n.º 3068/2019 - Autorização para comercializar por grosso e exportar substâncias estupefacientes, psicotrópicas e seus preparados concedida à entidade Sanifauna - Produtos Veterinários, Lda., nas suas instalações sitas na Estrada do Adarse, Centro Empresarial de Alverca, Vale das Ervas, D1, 2616-501 Alverca
Aviso n.º 3069/2019 - Autorização para comercializar por grosso, importar, exportar e trânsito de substâncias estupefacientes, psicotrópicas e seus preparados concedida à entidade Approcare International Unipessoal, Lda. (Zona Franca da Madeira), nas suas instalações sitas na Estrada Nacional n.º 9, Km 17, Terrugem, Vila Verde, 2711-901 Sintra
Aviso n.º 3070/2019 - Autorização para cultivo, importação e exportação da planta canábis, para fins medicinais concedida à entidade RPK Biopharma, Lda.
Aviso n.º 3071/2019 - Autorização para comercializar por grosso e exportar substâncias estupefacientes, psicotrópicas e seus preparados concedida à entidade Qualium Farma - Indústria Farmacêutica, Lda., nas suas instalações sitas na Rua Cláudio Galeno, Edifício Alloga, Cabra Figa, 2635-154 Rio de Mouro
Aviso n.º 3072/2019 - Autorização para comercializar por grosso e importar substâncias estupefacientes, psicotrópicas e seus preparados concedida à entidade Kimipharma, Lda., nas suas instalações sitas na Salispark Avenida das Nacionalizações, Lote 29, n.º 3 B, Lavradio, 2835-349 Barreiro
Aviso n.º 3073/2019 - Autorização para comercializar por grosso e importar substâncias estupefacientes, psicotrópicas e seus preparados concedida à entidade Iberlab & Imunoreage - Soluções para Laboratório, Lda., nas suas instalações sitas na Praceta da Castanheira, n.º 78, 4475-019 Maia


