Medicamentos para deixar de fumar
Utilização triplica de janeiro a abril
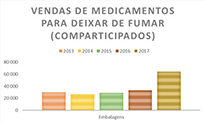
O número de pessoas a utilizar o medicamento Vareniclina, para deixar de fumar, disparou desde que o Estado iniciou a sua comparticipação em 37% em janeiro de 2017.
De acordo com dados do mercado total recolhidos pelo Infarmed, foram vendidas 24154 embalagens entre janeiro e abril de 2018, quase o triplo das 8749 vendidas no mesmo período de 2015. A comparticipação de Vareniclina (Champix) iniciou-se no âmbito de uma estratégia concertada para a desabituação tabágica, que passa também pelo aumento das consultas e locais de apoio ao cidadão que quer deixar de fumar.
É nesse contexto que decorre a prescrição de medicamentos para deixar de fumar, que beneficiam de uma comparticipação de 37%. De 2016 para 2017, a comparticipação fez quase duplicar as vendas, de 33231 embalagens para 64286. Subida semelhante verificou-se no valor de vendas deste medicamento, que subiu de 1,6 para 3,2 milhões de euros, tendo em conta os preços de venda ao público.

Dispositivos Médicos – Simplificação
do procedimento de atribuição de código
O Infarmed tem desenvolvido o processo de codificação de dispositivos médicos, destinados a serem adquiridos e utilizados no Serviço Nacional de Saúde (SNS), promovendo a consolidação de um repositório de informação que permita a caracterização do mercado, bem como o conhecimento relativamente à sua utilização no SNS, através da sua monitorização e com a salvaguarda da qualidade, segurança e sustentabilidade.
Considerando a necessidade de atribuição célere de Código de Dispositivo Médico (CDM), para efeitos de aquisição de dispositivos médicos pelo SNS, o procedimento para atribuição irá ser simplificado a partir do dia 1 de junho. Esta simplificação, que visa otimizar o processo de codificação no contexto do seu âmbito de aplicação, reside numa verificação formal dos atributos de codificação, que afetam a atribuição de CDM, sendo a restante informação analisada no âmbito de ações de fiscalização levadas a cabo por esta Autoridade.

Boletim de Farmacovigilância
Uma das atribuições do Infarmed é promover o acesso dos profissionais de saúde e dos consumidores às informações necessárias à utilização racional dos medicamentos e produtos de saúde.
Nesta edição do Boletim de Farmacovigilância destacamos a informação gráfica sobre o aumento muito significativo da notificação online de suspeitas de reações adversas a medicamentos, que se deve essencialmente ao novo Portal RAM, que permite aos profissionais de saúde e utentes comunicarem ao Infarmed, de forma mais fácil e rápida, contribuindo ativamente para a monitorização contínua da segurança e a avaliação do benefício/risco dos medicamentos. Com um novo interface e mais user-friendly, este novo Portal teve como objetivo contribuir para combater as causas da subnotificação, como sejam a falta de tempo, a complexidade ou a dificuldade de acesso aos meios de notificação. Por outro lado, as diversas campanhas de informação e ações de divulgação do Sistema Nacional de Farmacovigilância permitiram sensibilizar profissionais de saúde e cidadãos para a importância deste contributo.

Reunião Anual dos OMCL
Realizou-se, em Sarajevo, nos passados dias 14 a 18 de maio, o congresso anual dos laboratórios oficiais de comprovação da qualidade de medicamentos (Official Medicines Control Laboratories) onde na reunião do ano passado, Portugal foi eleito como membro do Advisory Group do GEON (General European OMCL Network).
Nesta reunião, Portugal realizou várias apresentações nomeadamente: utilização de indicadores de desempenho para monitorização da atividade laboratorial; monitorização do mercado português de medicamentos contendo pregabalina; ferramentas e ações desenvolvidas para divulgação da atividade do laboratório e participação portuguesa, enquanto Rapporteur, no âmbito do programa Centrally Authorised Products Generics Programme, coordenado pela Agência Europeia de Medicamentos/EDQM. No âmbito da libertação oficial de lote de medicamentos hemoderivados e vacinas, foram ainda discutidas quais as possíveis implicações do Brexit.
Portugal encontra-se no 5º lugar, dos 35 países que analisam medicamentos avaliados por procedimento de reconhecimento mútuo e descentralizado e mantém-se entre os 6 OMCLs que mais medicamentos derivados do plasma ou sangue humano analisam, no âmbito da libertação oficial de lote, antes da sua colocação no mercado.


